Sacado del blog "Un universo invisible bajo nuestros pies", de Juan José Ibáñez. Nota: La reproducción del artículo en nuestro blog cumple los requisitos de su licencia CreativeCommons)
Enlace al artículo publicado.
Enlace al artículo publicado.
La fijación biológica de N2 la realizan algunas bacterias libres o asociadas en simbiosis a vegetales y ciertas arqueobacterias. Es un proceso que globalmente tiene una variación relativamente baja de energía libre (-8 kcal/mol) pero la particular rotura del triple enlace que une a los dos atamos de N exige a la dinitrogenasa reductasa recibir un potencial reductor de apoyo sorprendentemente alto (-1.200 mv) equivalente a una variación de energía libre de +50 kcal/mol. Este potencial es el mas alto de los conocidos entre los procesos de óxido reducción biológica.
A pesar de los problemas que plantea, el sistema es tan eficaz que se ha constituido en la principal fuente natural de entrada de N en la biosfera. Y es bueno recordar que todos los seres vivos tienen compuestos en los que éste elemento está presente, siempre en forma reducida. Baste mencionar a las proteínas de todo tipo y función, los aminoglúcidos, los ácidos nucléicos, las poliaminas, las vitaminas, los responsables de la disponibilidad de la energía (ATP y GTP) y del potencial reductor (NAD(P) y FAD) y un largo etc., sin los cuales el desarrollo de la vida en la Tierra no se concibe como hoy lo entendemos.
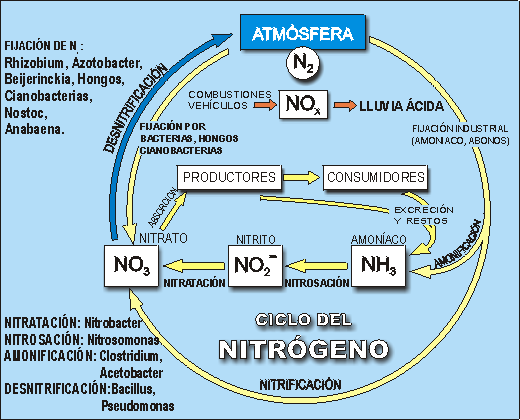
La fijación de fijación de N2 es un proceso redox estrictamente anaerobio. Lo desarrolla un complejo enzimático denominado Nitrogenasa del que la naturaleza nos muestra tres tipos:
Tipo I que es aquel que se conforma en medios donde hay suficiente molibdeno.
En el que hay que distinguir dos componentes diferenciados:
- la dinitrogenasa 1, componente I que Molibdoferredoxina, que presenta centro metálicos implicados funcionalmente en la reducción del N2 Son los centros P conformados por cuatro clúster “4Fe-4S” cuya función es la de almacenar y transferir los electrones que se precisan para desarrollar el proceso de reducción y dos cofactores de “Fe7MoS9 homocitrato” (llamados amigablemente FeMoco) conocidos cristalográficamente desde 1992, donde se realiza la unión y la reducción del N2 y también donde ejerce su acción inhibidora el O2. El FeMoco es bastante lento, y tiene errores de reconocimiento, pues frecuentemente confunde el triple enlace del N2 con el del acetileno lo que convierte a este proceso en uno de los grandes productores de metano. También recibe a los cianuros, isocianuros, azidas y óxido nitroso. El monóxido de carbono es un inhibidor competitivo y el oxígeno bloquea el centro activo definitivamente.
- la nitrogenasa reductasa 1 ó componente II, un homodímero que contiene cuatro clúster 4Fe-4S actuando como puente entre sus cuatro proteínas conformacionales cuya masa molecular alcanza los 60.000 Kda (ferredoxina). Cuando las concentraciones de Fe disponible en el medio son bajas es sustituida por una flavodoxina. Su responsabilidad funcional se centra en donar electrones para la dinitrogenasa I (el otro componente). En muchos casos la fuente donadora de electrones es el ácido pirúvico, gracias a la actividad de una piruvato flavadoxin reductasa acoplada, que cede los electrones a la flavodoxina.
Tipo II propias de bacterias que como el Azotobacter, crecen en medios donde no hay Molibeno y el Vanadio le sustituye. Ahora los dos componentes diferenciados son:
· la dinitrogenasa 2, hexámero formado por dos pares de proteínas de igual longitud a2 y b2, y un par de proteínas mas cortas d2. En estas últimas subunidades se ubica un cofactor “FeVaco” que es equivalente al “FeMoco” además de 23 átomos de Fe y 20 grupos –SH .
· La nitrogenasa reductasa 2, formada por holodímeros de 64.000 kDa de masa molecular que contiene en cada dímero 4 Fe y 4 terminales –SH. Es responsable del flujo electrónico que proporciona los 8 electrones necesarios para la formación de amonio, por lo que, en el proceso deben de aparecer oxidados 8 terminales –SH.
· La eficiencia disminuye dado que el N2 tiene mas dificultades para ubicarse y quedar retenido en forma y tiempo para que la reducción se realice.
El tipo III se conforman en medios donde existe una carencia simultánea de Mo y V. El Azotobacter también puede expresar este complejo. En esta situación el Mo(IV) o el V(III) se sustituye por el Fe(III) viéndose a llamar al cofactor “FeFeco”
· La dinitrogenasa 3. se conforma con tetrámeros cuya masa molecular alcanza del 216 kDa. Presenta una organización protéica a2b2 no estando clara la existencia de d2. El cofactor FeFeco es el menos eficiente de los tres.
· La nitrogenasa reductasa 3 es un holodímero que contiene 4 Fe y 4 –terminales –SH por dímero
La presencia de Mo disponible en el medio es fundamental para generar el tipo mas eficaz como catalizador, pues su presencia reprime los genes que expresan a los conjuntos de los tipos II y III.
Durante el proceso de reducción del N2 se generan N2H2, compuesto muy inestable que reconduce el proceso generando N2 e H2. Como muchas de las bacterias libres fijadoras de N2 tienen una hidrogenasa, el H2 lo reciclan en la formación de potencial reductor (NADPH) que alimenta en parte a la nitrogenasa reductasa, evitando perderse en el medio. Este es el caso de anaerobias estrictas como el Clostridium o las bacterias metanogénicas. Si la bacteria es facultativa como en la Kleibsela o la Escherichia coli, la fijación de N2 solo se realiza en condiciones de anaerobiosis. También poseen esta capacidad fijadora las bacterias con fotosíntesis anoxigénica como es el caso de las Rodobacter.
Sin embargo una nueva estrategia se desarrolla en biología, es la asociación simbiótica, en la que la planta enclaustra a la bacteria fijadora de N2 generando un ámbito en el que el paso del O2 está controlado molécula a molécula, y evitando de esta forma la libertad del O2 para asociarse al componente FeMoco, anulando su actividad. Es el caso del Rhizobium, en el que la planta hospedadora (leguminosa) le genera un ámbito microaerófilo y el paso del O2 lo controlan unas moléculas llamadas leghemoglobinas. Así el oxígeno, como receptor final del flujo electrónico de una cadena redóx, cuya única finalidad es la de servir para generar únicamente el potencial redox que precisa el proceso está controlado. Estas leghemoglobinas están generadas de manera coordinada por los dos actores, la bacteria y la planta. Así el grupo globina (glicoproteina) se codifica en los genes del vegetal y el grupo hemo en los genes bacterianos, y ambos conjuntos genéticos solo se activan cuando se ha conformado el nódulo en el interior de la raíz... o de tallo o en la hoja. En estas plantas micorrizadas, la fuente de potencial reductor más importante proviene del consumo de sacarosa, posiblemente almacenada en el tallo de la planta, la cual, una vez ubicada en el ámbito del nódulo libera glucosa y posteriormente ácido pirúvico. Y aparece un cambio en el comportamiento nutricional de las raíces. Ahora asimilan únicamente aminoácidos, mientras el proceso de fijación de N2 está activo.
Como en otros ámbitos metabólicos (síntesis fotosintética de monosacáridos, síntesis de ácidos grasos y síntesis de bases pirimídicas) la relación CO2/O2 tiene una gran importancia en el ámbito bioquímico- enzimático de la fijación biológica de N2. Pero además del motivo general de regulación de todas las síntesis mencionadas (regulación de la velocidad y eficacia del proceso) hay que otro específico ya mencionado (el O2 es un tóxico para el conjunto enzimático que lleva a cabo la reducción del N2 molecular). El conocimiento de ambas actuaciones tiene suma importancia a la hora de manejar los suelos y aportar (científicamente) abonos nitrogenados en momentos “clave” del desarrollo productivo. Revisemos ambos conceptos.
En primer lugar, una de las opciones que tuvo el proceso de fijación de N2 era liberar directamente NH4, pero éste ión, incluso en pequeñas cantidades, genera toxicidad por sus capacidades para reaccionar con radicales ácidos presentes en muchas biomoléculas y por su basicidad, reconocida, que generaría cambios conformacionales no deseados en el ámbito citosólico. Para evitar estos hechos, en sus inicios se generaron dos estrategias, casi simultáneamente: la morfológica (el proceso se aísla dentro de una orgánulo subcelular) y la metabólica (el metabolismo usa, para neutralizar al ión amonio, al ácido glutámico, y una ruta complementaria de síntesis acelerada de soportes orgánicos a partir del fosfoenolpirúvico y el CO2 del suelo o agua, para formarle). Para conseguirlo, las tasas de CO2 en el medio de desarrollo del fijador de N2 deben de ser altas y la cantidad de O2 (que también se precisa para generar la energía y el potencial reductor que exige el proceso de reducción del N2), baja.
En los momentos y ambientes donde se inicia la fijación de N2, hay que echar mano del ciclo reductor de los ácidos tricarboxílicos, (encontrada por Evans en 1966 en el Clostridium thiosulphatophlum). La abundancia de CO2 justificaba la vía del acetil-CoA, con formación secuenciada de piruvato, oxalacetato, málico, fumárico, succínico, succinil-CoA y a-cetoglutárico. Así, el recrecimiento molecular del acetil-CoA hasta a-cetoglutárico (receptor de NH4) exige un costo “ambiental” de 3 moléculas de CO2.
De toda esta secuencia de compuestos, un significativo porcentaje de dos aniones malato (formado a partir de la actividad del “”malic enzyme” y de la tasa de CO2 radicular) y succinato (por reducción del anterior), penetran en el interior del nódulo fijador de N2. Allí, además de ejercer un control estricto del pH (fundamental para su actividad), una reconversión parcial en pirúvico, les permite recoger parte del NH4 generado en el proceso, formando g-amino butírico y alanina, (formas en las que el N, ahora reducido, volverá al citosol, donde será cedido al glutámico y produciendo glutamina gracias al enzima glutamín sintetasa) . Además, los electrones que se liberan al oxidarse el succínico a málico, circularán por una especial cadena de redox que contiene el recinto de fijación, aportando potencial reductor para el funcionalismo de la nitrogenasa reductasa, mientras que, en el citosol, los equipos enzimáticos sintetizarán glutámico a partir del a-cetoglutárico y glutamina, conformando de esta forma la cantidad de glutámico suficiente para recoger el amonio formado.
Estos hechos convierten a la glutamina en el distribuidor principal N2 reducido, teniendo como “sunt” secundarios de distribución del nitrógeno a la asparragina y prolina y cuyas implicaciones las describen en Lance y Rustin (1984) en lo denominan “la ruta del malato, como impulsora del crecimiento vegetal”.
Si Hamilton y cols, (1984) nos muestran en distintas especies de Achoromobacter que la aportación del N2 es esencial para impulsar el consumo de CO2, Soussi y cols (1999) por citar a tres bioquímicos españoles, que en la Universidad de Granada además de mostrarnos a los aminoácidos receptores principales de las formas reducidas del N (ácido glutámico y aspártico) y las minoritarias (alanina, ornitina, arginina y glicocola), buscan nuevas formas adaptadas de Cicer arietinum, a medios salinizados.
Pero todo los expuesto hasta ahora no es mas que un reflejo de unas inquietudes que vienen desde muy antiguo. Ya en 1804, Sousure nos decía “se puede incrementar la acumulación de materia orgánica seca en los cultivos de legumbres, por medio de una fertilización con CO2, cuando la asimilación de C está limitada”. Reídle (1916) patenta y comercializa un abono enriquecido en CO2, que al aplicarlo a patata, cebada, altramuz y alubia consigue incrementar en mas de un 50% el peso seco de la planta y multiplicar por cinco la nodulación.
Un paso mas lo da Wilson en 1931 al comprobar una asociación real entre los procesos de fotosíntesis y fijación de N y Hardy (1975-76) indica que la nodulación responde a una fertilización con CO2 a corto y largo plazo e indica algo más: la fotosíntesis puede afectar a la actividad de fijación de N por dos razones muy claras:
- descenso en la cantidad y disponibilidad de sustratos carbonados reducidos, cuyos aportes provienen, vía floema, y en forma de sacarosa de la actividad fotosintética y se implemente por la tasa de CO2 radicular cuya explicaciones ya he realizado, constituyendo un metabolismo complementario que se puede manejar. Como informaciones complementarias, diré que el costo medio para reducir 1 mg de N (N2 gas) es mas o menos de 6 mg de C en sacarosa, que el proceso se desarrolla tanto de día como de noche y que cuando el “costo de C/mg de N2 fijado desciendo, la materia orgánica de la planta cambia su composición, que se hace mas rica en proteínas y mas pobre en polisacáridos.
- descenso en la presencia de nitrogenasa o de su actividad en los nódulos.
Como se puede suponer, a partir de lo antedicho, el manejo del suelo afecta muy particularmente a la atmósfera en el entorno radicular, y el manejo de la fertilización nitrogenada cobra suma importancia, dado que una aportación de formas reducidas de amonio, afectarán de manera directa al proceso bioquímico de fijación de N, la cual tiene indudable interés agronómico.
Así, la movimientos de suelo que conduzcan a un incremento del O2 gas en la atmósfera del suelo o en el entorno radicular, disminuirán la eficacia del proceso de fijación de N. Por el contrario, procesos de conduzcan al incremento de las tasas de CO2 en el ámbito rizosférico lo promocionarán. Por ello tiene tanta importancia la conservación de una microbiota capaz de respirar cantidades suficientes de CO2, y la existencia de nutrientes microbiológicos en el suelo, que limiten los procesos de rizodeposición, cuyo C elaborado, procedente de directamente de la fotosíntesis, puede servir para otros procesos que incrementen la productividad vegetal.
Si tenemos en cuenta que en el suelo, la presencia acumulada de compuestos orgánicos nitrogenados reducen la expresión de los genes nif y la del ión amonio les reprime totalmente, debemos de conocer en cada caso cual es el momento preciso para no “gastar sacarosa” en el proceso de fijación de N y desviarla, durante el entallado, hacia la construcción de estructuras vegetales y durante la fructificación hacia la formación de sustancias de reserva. Esto solo se conseguirá manejando adecuadamente cantidades adecuadas de fertilizantes nitrogenados amónicos en los momentos fenológicos de la planta apropiados.
0 comentarios:
Publicar un comentario